2020年5月15日,北京安智因生物技術(shù)有限公司正式進入商務(wù)部確認取得國外標準認證或注冊的醫(yī)療物資生產(chǎn)企業(yè)清單(“白名單”),成為 “白名單”內(nèi)的企業(yè)。自此,北京安智因生物技術(shù)有限公司有了一張向歐盟出口醫(yī)用物資的“特別通行證”。
“白名單”是商務(wù)部確認取得國外標準認證或注冊的醫(yī)療物資和非醫(yī)用口罩生產(chǎn)企業(yè)清單。
為全力支持國內(nèi)和國際社會抗擊疫情,繼今年3月31日商務(wù)部聯(lián)合海關(guān)總署、國家藥監(jiān)局聯(lián)合發(fā)布5號公告后,再次發(fā)力,商務(wù)部聯(lián)合海關(guān)總署、市場監(jiān)管總局三部委發(fā)布12號公告,強調(diào)自4月26日起,嚴格對非醫(yī)用口罩的出口質(zhì)量監(jiān)管,同時,進一步規(guī)范醫(yī)療防疫物資的出口秩序。
根據(jù)公告精神,產(chǎn)品只要符合中國質(zhì)量標準或國外質(zhì)量標準,均可實現(xiàn)出口。但出口企業(yè)必須向海關(guān)提交出口方和進口方的共同聲明,確認產(chǎn)品合規(guī),且進口方必須承諾接受所購產(chǎn)品的質(zhì)量標準,確保非醫(yī)用口罩不得用于醫(yī)用用途。海關(guān)將憑商務(wù)部提供的企業(yè)名單驗放,市場總局查處的不符合中國標準的產(chǎn)品和企業(yè)將被剔除。
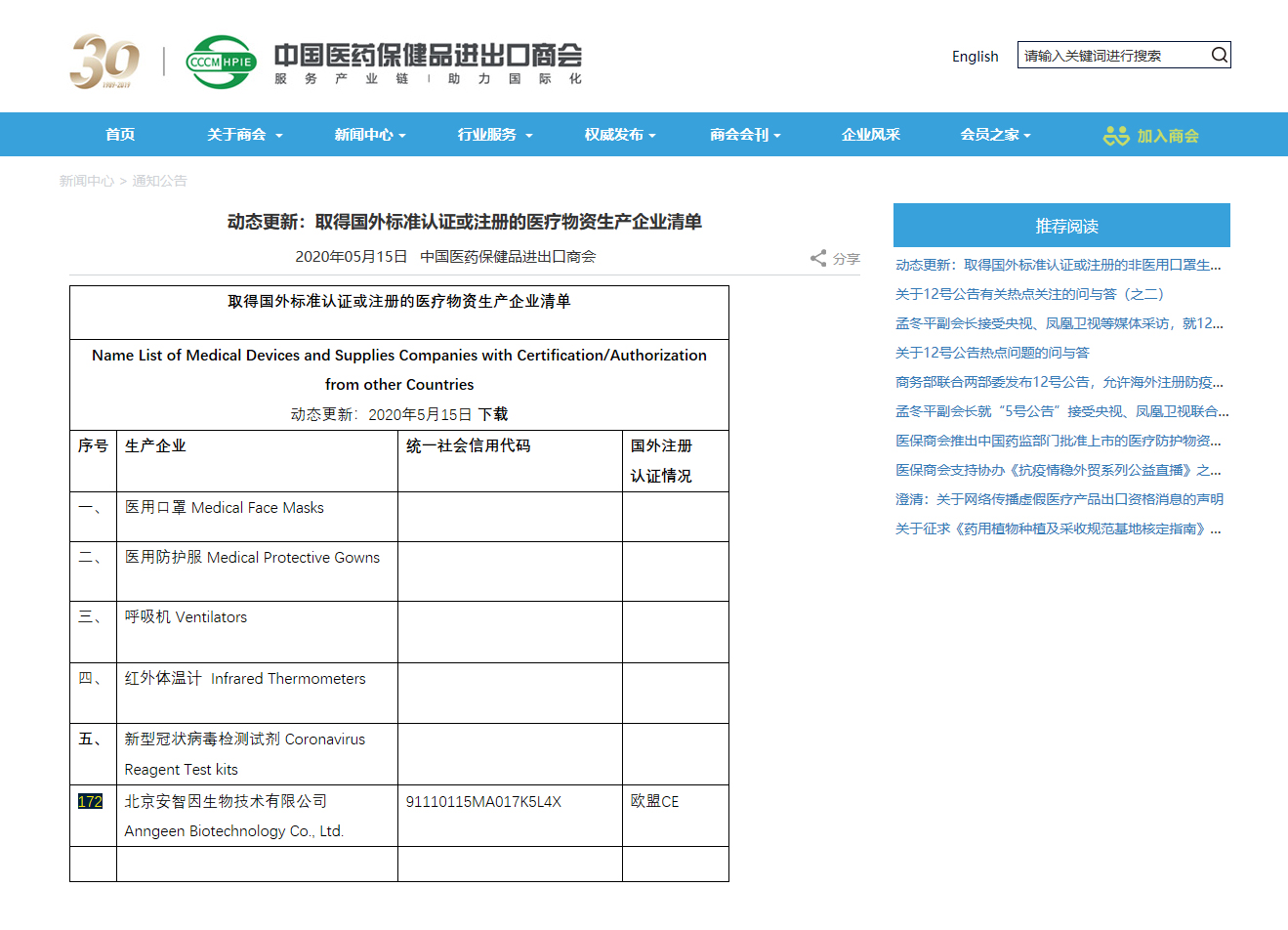
取得國外標準認證或注冊的醫(yī)療物資生產(chǎn)企業(yè)清單
——中國醫(yī)藥保健品進出口商會
原文鏈接:http://www.cccmhpie.org.cn/Pub/6325/176257.shtml
公告發(fā)布后,安智因生物第一時間聯(lián)系北京市商委,積極快速的按照12號公告要求提交相關(guān)表格和證明材料。經(jīng)過商務(wù)部專家評審后,成為全國第172家新型冠狀病毒檢測試劑“白名單”企業(yè)。
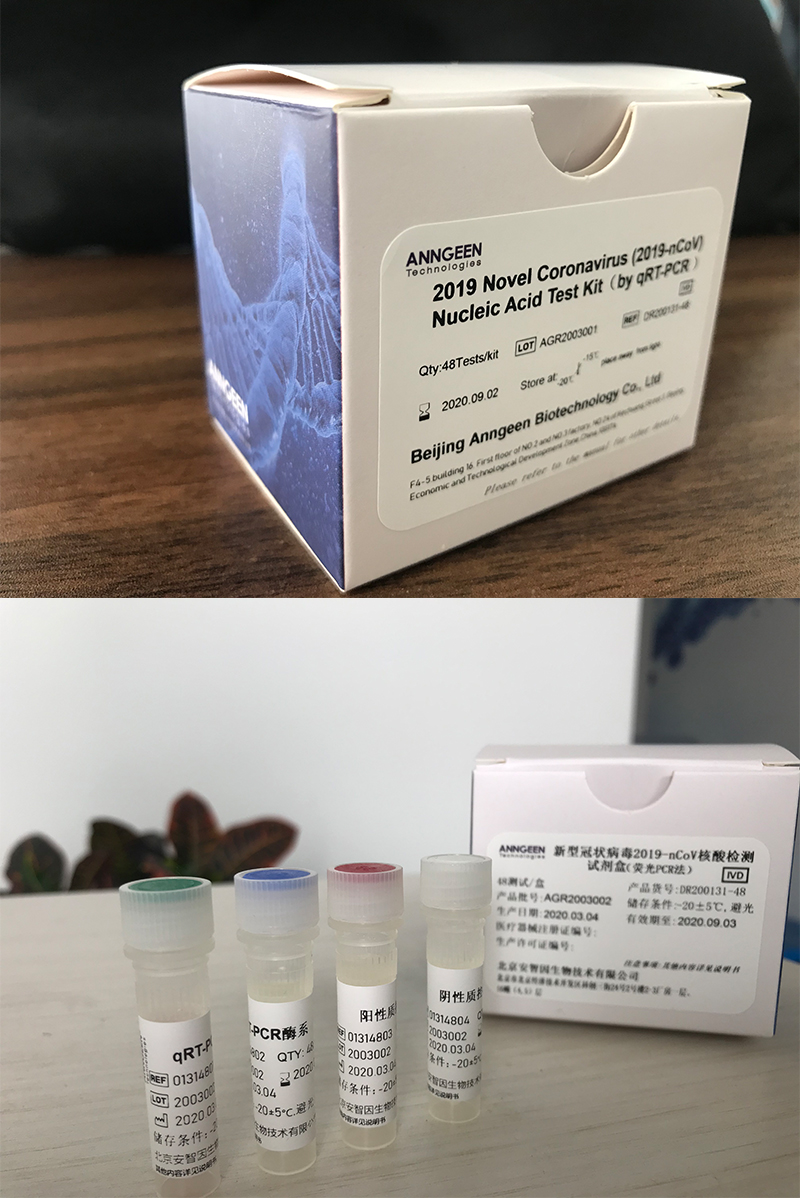
北京安智因生物技術(shù)有限公司是經(jīng)科技部認定的國家科技型中小企業(yè),致力于應(yīng)用高通量基因測序技術(shù),為臨床醫(yī)學(xué)篩查和診斷提供整體解決方案的生物創(chuàng)新型企業(yè)。是我國遺傳性疾病篩查和診斷的領(lǐng)先者。目前,公司所研發(fā)的新型冠狀病毒2019-nCoV核酸檢測試劑盒(熒光PCR法)為公司自主研發(fā)產(chǎn)品。