

摘要
DNA損傷修復(DDR)在實體瘤(包括卵巢癌)的發生中起重要作用。在DDR效應通路中,多種實體瘤(如乳腺癌、結直腸癌和卵巢癌)遺傳學水平的實質性變化就是DNA修復基因的基因組改變,尤其是在攜帶已知DNA修復基因胚系突變的高外顯率家族性腫瘤中,例如乳腺癌相關的BRCA1/2突變,結直腸癌和卵巢癌(OvC)相關的錯配修復基因突變(包括MLH1、MSH2、MSH6、PMS2和POLE)或聚合酶缺陷,以及OvC相關RAD51C、RAD51D基因的有害突變和BRCA1突變。卵巢癌相關的其他分子標志物還包括TP53、KRAS、BRAF、RAD51C/D或PTEN等。本文闡述了DNA修復機制對卵巢癌發生風險、預后和治療結局的影響。
卵巢癌的主要分子特征及其與DNA修復系統的關系
90%的OvC為上皮性卵巢癌(EOCs),主要分為Ⅰ型和Ⅱ型兩個亞型,Ⅰ型由子宮內膜樣、粘液樣、透明細胞和低級別漿液性卵巢癌組成,Ⅱ型包括高級別漿液性卵巢癌(HGSOCs),屬于組織學優勢亞型。DNA修復系統的蛋白由150多個基因編碼并具有典型特征,OvC涉及六個途徑:其中同源重組修復(HR)缺陷、非同源末端連接(NHEJ)、錯配修復(MMR)、堿基切除修復(BER)和核苷酸切除修復(NER)主要與OvC起源、發病機制和對化療的反應相關,而損傷直接修復與OvC的關系研究較少。相關研究表明,所有DNA修復通路都參與了卵巢癌的發生(見圖1)。位于G1/S檢查點的DNA損傷修復主要通過NHEJ、BER、NER途徑;S期檢查點的DNA損傷修復通過MMR、HR、NHEJ、BER等途徑;G2/M檢查點的DNA損傷修復途徑主要為NHEJ、BER和HR。
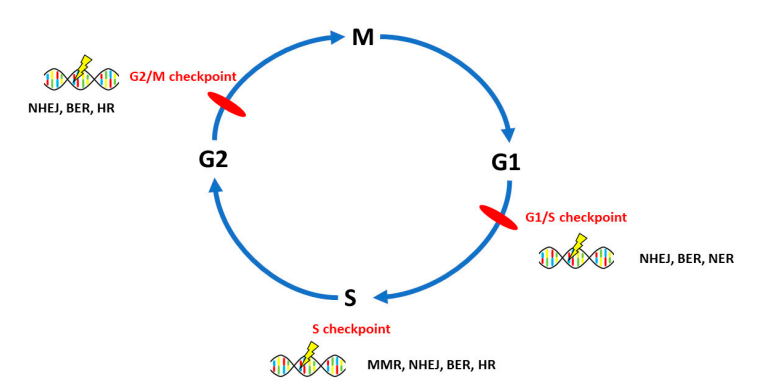
圖1 DNA修復途徑及其在細胞生物學中的意義
從分子分型來看,臨床上最常見的侵襲性II型卵巢癌(主要是HGSOC)的典型特征是TP53的體細胞突變、染色體不穩定和經常出現的同源重組(HR)缺陷。HGSOC中有96%的病例發生TP53突變,其中約50%的腫瘤由于胚系和體細胞BRCA突變、BRCA表觀失活和DNA修復基因異常而表現出HR缺陷。約10-20%的上皮性卵巢癌(EOC)的危險因素是BRCA1/2胚系突變。I型EOC包括低級別漿液性和粘液性卵巢癌,通常發生KRAS和BRAF突變,還有ARID1A、CTNNB1、PIK3CA、PTEN基因突變。與EOC發病風險相關的基因還包括BRIP1、RAD50、RAD51C、RAD51D、BARD1、CHEK2、MRE11A、PALB2、ATM。
DNA修復通路參與卵巢癌的發生、發展和預后
01
同源重組修復(Homologous Recombination Repair,HRR)
HR是一種重要的高保真DNA修復途徑,可對DNA缺口(gaps)、DNA雙鏈斷裂(DSBs)和DNA鏈間交聯等復雜DNA損傷進行修復,具有模板依賴性(見圖2)。大約50%的HGSOC中存在HR通路缺陷,OvC患者的HR缺陷主要是由高外顯率易感基因BRCA1/2的胚系和體細胞突變驅動的。BRCA1和BRCA2蛋白在DBSs修復中發揮重要作用,BRCA1和BRCA2基因突變與遺傳性乳腺癌和OvC的高風險相關。研究表明,與非攜帶者相比,BRCA1/2突變攜帶者的生存率顯著提高,可能部分與他們對鉑類化療的敏感性增強有關。非攜帶者的五年生存率為36%,BRCA1和BRCA2突變攜帶者的5年生存率分別為44%和52%。HR缺乏的OvC患者接受鉑類化療后表現出顯著較高的反應率和延長的無進展生存期(PFS)。
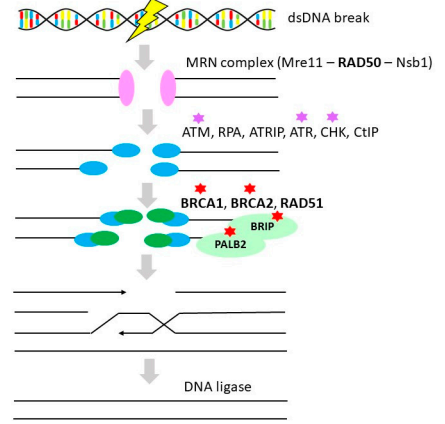
圖2 同源重組(Homologous recombination)
注:粗體代表OvC中的基因改變,紅星代表OvC治療的靶點(PARP抑制劑),紫星代表檢查點抑制劑。
此外,RAD51C和RAD51D突變與EOC的風險相關,可用于常規臨床基因檢測。RAD51同源基因被認為是中度外顯的OvC易感基因,約占OvC病例的1%。PALB2和BRIP1是HR的另外兩個重要成員,PALB2與BRCA2、BRCA1和DDR家族的幾個成員相互作用,BRIP1具有ATP酶和解旋酶活性,可增加OvC的易感性。
02
非同源末端連接(Non-Homologous End-Joining,NHEJ)
NHEJ是DNA DSBs最有效的修復途徑。與HR不同,DNA損傷直接連接而無需同源模板。由于不需要姊妹染色單體(在S期和G2期可用),NHEJ可貫穿于整個細胞周期(見圖3)。NHEJ涉及的胚系突變與嚴重的免疫缺陷、發育異常、基因組不穩定以及不同的癌癥類型有關,例如白血病、膀胱癌。XRCC4和LIG4是與OvC相關的NHEJ通路的兩個成員,XRCC4的高表達與OvC患者的不良預后相關;LIG4是NHEJ中的一種必需蛋白,與XRCC4形成復合物,目前沒有充足的證據證明LIG4與OvC的風險和預后相關。
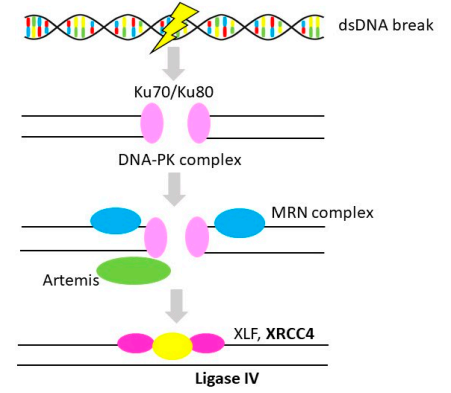
圖3 非同源末端連接(Non-Homologous End-Joining)
注:粗體代表OvC中的基因改變。
03
錯配修復(Mismatch Repair,MMR)
除BRCA1和BRCA2突變外,MMR缺陷是遺傳性OvC的最常見致病因素。MMR系統可以糾正DNA復制或重組過程中產生的DNA堿基錯配或插入/缺失,如圖4所示。MMR基因(MLH1、MSH2、MSH6和PMS2)的胚系突變或MSH2表達缺失可能導致Lynch綜合征(也稱為遺傳性非息肉病結直腸癌),該綜合征患者發生OvC的累積風險為6-12%。由于DNA MMR失活而出現的特征分子標記稱為微衛星不穩定性(MSI)。OvC患者中MSI的發生率約為2-20%,主要涉及子宮內膜樣(19.2%)、粘液樣(16.9%)、透明細胞(11.2%)和漿液性(7.9%)亞型。
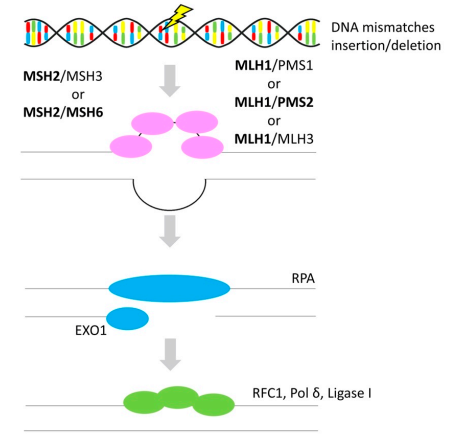
圖4 錯配修復(Mismatch Repair)
注:粗體代表OvC中的基因改變。
04
堿基切除修復(Base Excision Repair,BER)
BER是DNA修復機制的重要組成部分,負責修復由內源性(代謝產物)和外源性(輻射、化學物質、藥物)損傷引起的堿基損傷(烷基化、氧化、脫氨、脫嘌呤或單鏈斷裂(SSBs))。BER由DNA糖基化酶、APE1、POLB、FEN1和LIG1(或LIG3)幾個部分組成,還有PARP1或XRCC1(見圖5)。
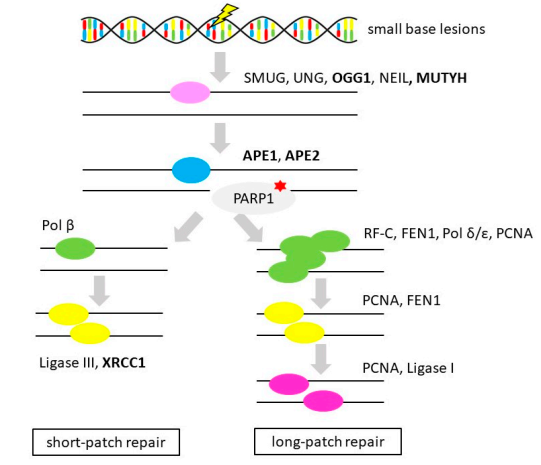
圖5 堿基切除修復(Base Excision Repair)
注:粗體代表OvC中的基因改變,紅星代表OvC治療中考慮治療干預措施(PARP抑制劑)。
05
核苷酸切除修復(Nucleotide Excision Repair,NER)
NER可識別出大的DNA雙鏈螺旋扭曲和DNA化學改變,主要包括紫外光產物、多環芳香烴、芳香族胺、鉑化產物等(見圖6)。NER途徑中幾種蛋白質的缺乏與三種罕見的常染色體隱性遺傳綜合征有關,Cockayne綜合征,著色性干皮病和光敏形式的硫營養不良。一項研究對89例OvC患者和356例對照人群中NER基因(包括XPA、XPC、XPD/ERCC2、XPF/ERCC4、XPG和ERCC1)的17個SNP進行分析,結果表明ERCC1、XPC和XPD/ERCC2可能與OvC的易感性有關。
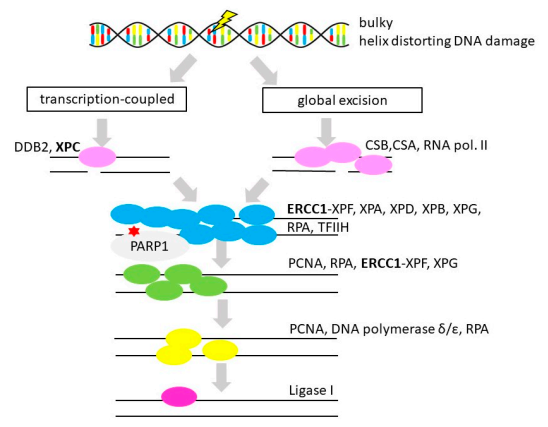
圖6 核苷酸切除修復(Nucleotide Excision Repair)
注:粗體代表OvC中的基因改變,紅星代表OvC治療中考慮治療干預措施(PARP抑制劑)。
06
直接修復(Direct Repair)
與其他DNA修復機制不同,直接修復是一種相對簡單的方法,可去除一些DNA和RNA修飾。堿基損傷在單一酶反應中被消除,不用切斷DNA或切除堿基,可實現無差錯修復(見圖7)。最常見的修飾包括由表觀遺傳機制引起的DNA烷基化損傷或RNA甲基化。
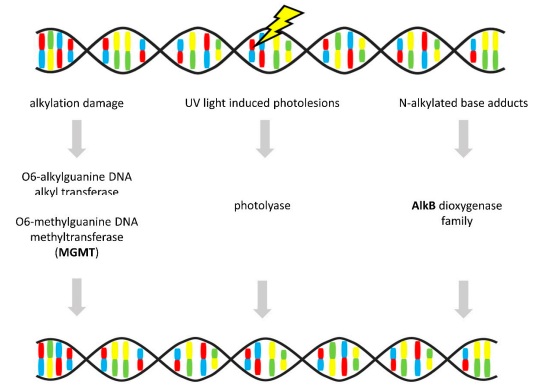
圖7 直接修復(Direct Repair)
注:粗體代表OvC中的基因改變。
卵巢癌治療——DNA修復系統的靶點
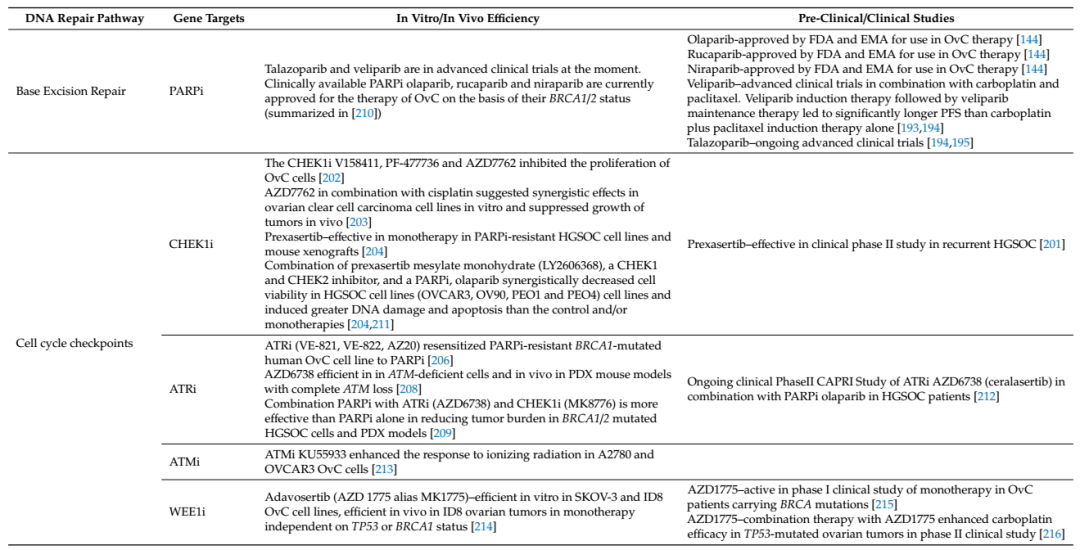
OvC的一線治療以手術為主,其次是鉑衍生物和紫杉類藥物(通常是卡鉑+紫杉醇)聯合治療。然而, 70-85%的患者會在初期緩解后復發,復發性OvC的中位生存期為12-24個月。目前,新的治療方法直接針對分子靶點和信號通路,例如抗血管生成劑(如貝伐單抗或帕唑帕尼),生長因子信號抑制劑,葉酸受體抑制劑,AKT信號抑制劑,免疫治療方法和PARP抑制劑(PARPi)。DNA修復靶向藥已成為OvC的主流治療選擇,其目的在于檢測DNA損傷,協調DNA修復,啟動信號通路促進細胞周期檢查點激活,觸發細胞凋亡(見表1)。
表1基于DNA修復通路的卵巢癌靶向藥研究進展
總結
雖然新的治療策略不斷涌現,OvC的長期療效仍不能令人滿意(五年生存率30%~50%不等)。研究表明,DNA修復機制與OvC的發生風險、疾病特征以及療效預測有關。DDR與DNA修復系統的功能狀態決定腫瘤的發生,并影響化療療效和預后。DNA修復通路基因的高通量遺傳圖譜使我們能夠鑒定和篩選與OvC預后和療效相關的關鍵基因(見圖8和表2)。
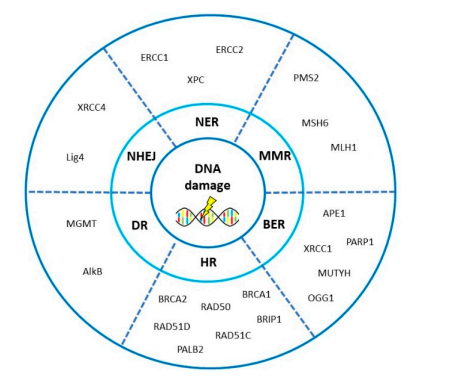
圖8 卵巢癌(OvC)相關DNA修復途徑的關鍵基因
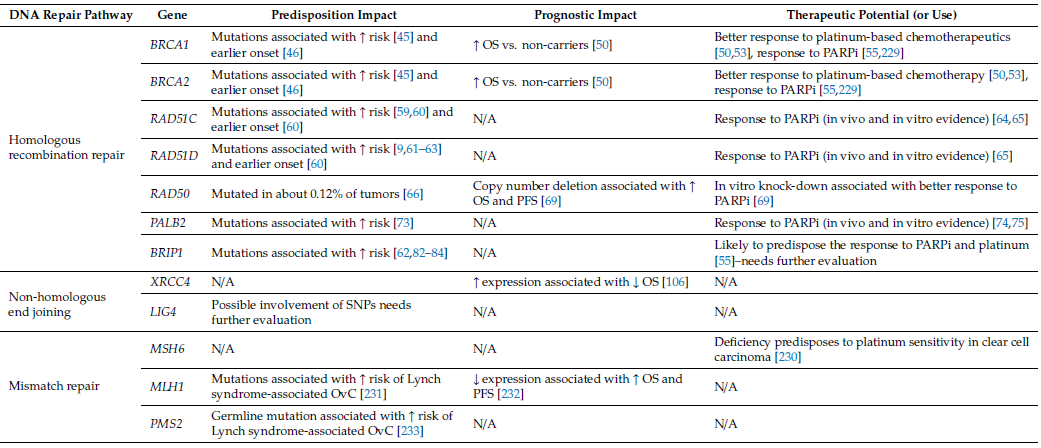
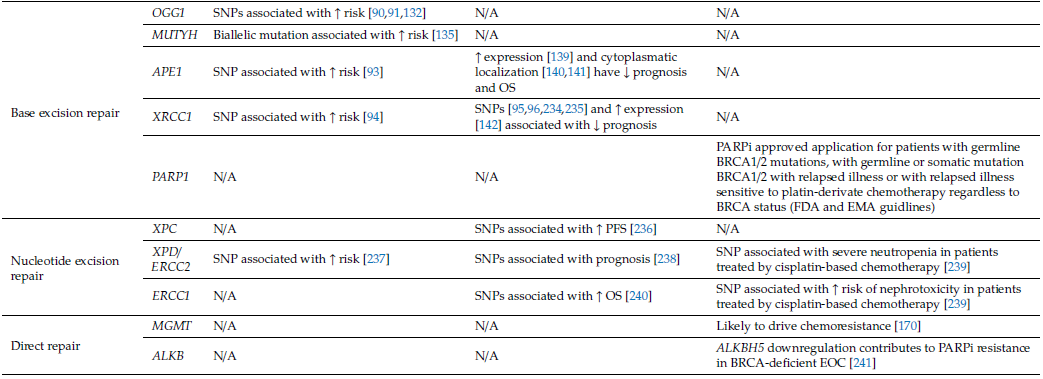
表2 DNA修復系統關鍵基因對卵巢癌遺傳易感性、預后和靶向治療的影響
參考文獻:
Tomasova K, Cumova A, et al. DNA Repair and Ovarian Carcinogenesis: Impact on Risk, Prognosis and Therapy Outcome. Cancers (Basel). 2020 Jun 28;12(7):E1713.