

血液腫瘤是一種高度異質性疾病,大部分患者經過治療后可以達到完全緩解。血液學完全緩解后,患者的骨髓、外周血或其他髓外組織中仍然存在著少量的白血病細胞,稱為微小殘留病(measurable residual disease,MRD)。MRD在血液腫瘤復發預測,療效評估方面發揮著十分重要的作用(圖1),白血病細胞負荷越高,復發風險越大,藥物療效越差。
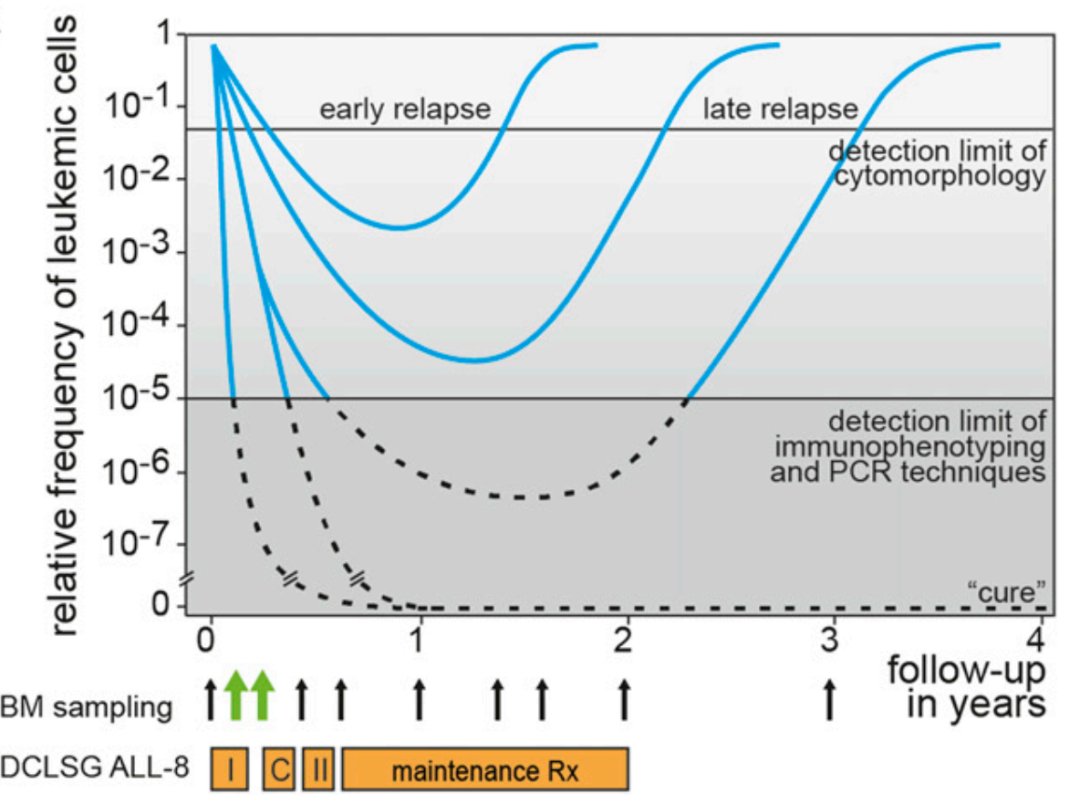
圖1 MRD監測在白血病復發預測中的意義
目前的MRD監測方法主要有多參數流式細胞術(multiparameter flow cytometry,MFC)、熒光實時定量聚合酶鏈式反應(quantitative polymerase chain reaction,qPCR)和二代測序(next generation sequencing,NGS)。
01
MFC監測MRD
白血病細胞具有異常的抗原表達,稱為白血病相關免疫表型(leukemia-associated immunophenotypes,LAIPs)。LAIPs分為抗原非同步表達、抗原的跨系表達、正常抗原表達強度改變和抗原表達缺失4類。流式細胞術以LAIPs為基礎進行MRD監測。
MFC監測MRD的適用范圍廣,檢測周期短,特異性高,但是監測指標缺乏標準化,需要專業分析人員,且治療后的殘留白血病細胞免疫表型可能發生改變(抗原漂移),造成假陽性或假陰性。
02
qPCR監測MRD
正常細胞與血液腫瘤細胞具有不同的分子生物學異常,正常細胞中不表達或低表達的mRNA轉錄本在白血病細胞中呈現高表達,例如急性髓系白血病患者中的WT1高表達,正常B/T淋巴細胞的IG/TCR重排多樣化,B/T細胞淋巴瘤的IG/TCR重排單一化(圖2);血液腫瘤細胞中還存在基因突變和基因融合。在具有基因突變、融合、過表達和重排的血液腫瘤患者中,可采用qPCR技術進行MRD監測。
qPCR靈敏度高,特異性好,監測速度快,但是覆蓋面窄,需要多種不同的引物和探針,且受擴增效率和背景表達的影響較大。由qPCR發展而來的液滴數字PCR屬于絕對定量方法,可檢測基線復雜和含量極低的核酸序列,但也存在覆蓋面窄,標志物多等局限性。
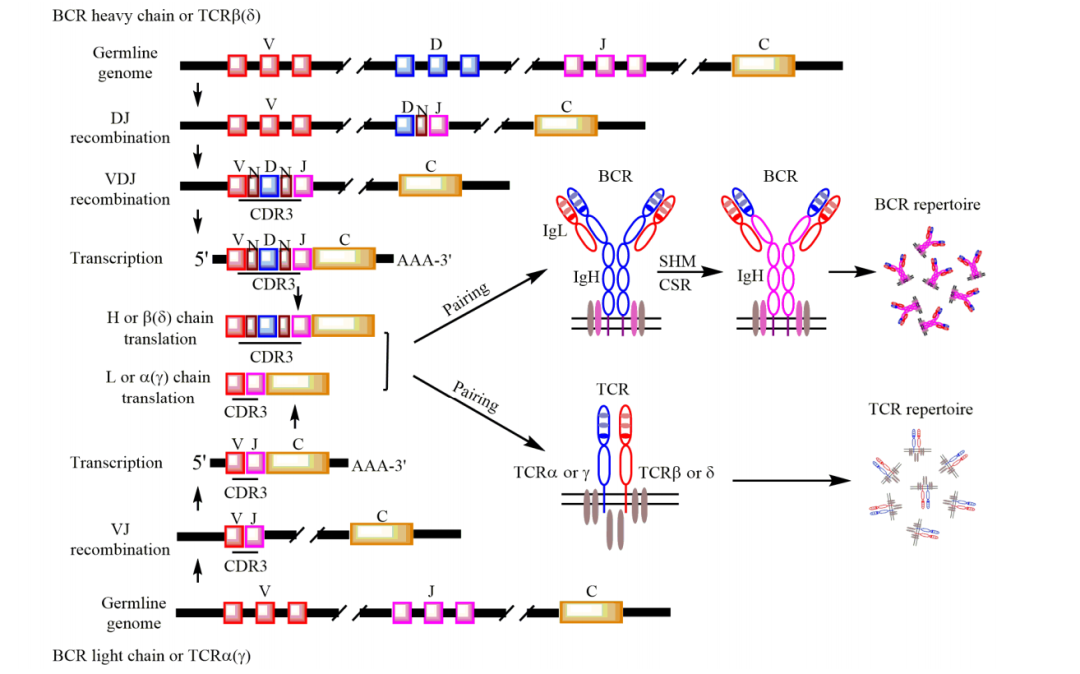
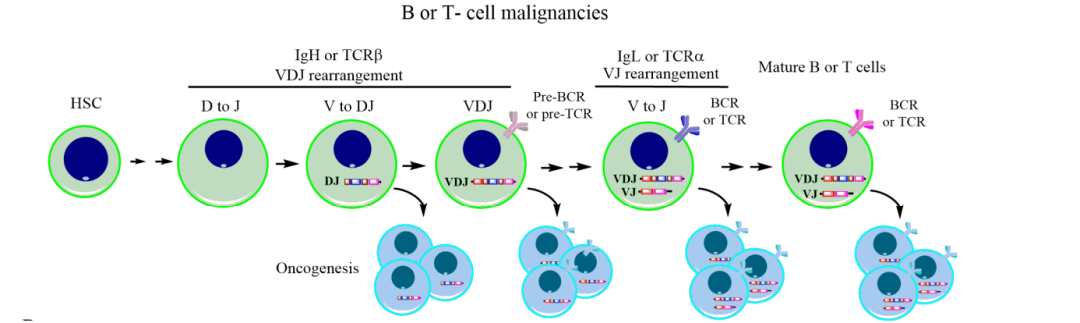
圖2 正常細胞與B/T腫瘤細胞基因重排
03
NGS監測MRD
血液腫瘤患者體內經常存在多個突變,而qPCR技術通量低,一般一次只能檢測一個外顯子突變。NGS技術通量高,可同時檢測多個突變,提高效率的同時也能更全面地了解患者的遺傳信息。然而,NGS的檢測費用較高,還可能引入一些原始樣本基因組并不存在的錯誤,導致假陽性。因此,檢測實驗室應建立標準化實驗和數據解讀流程,提高檢測的準確率。
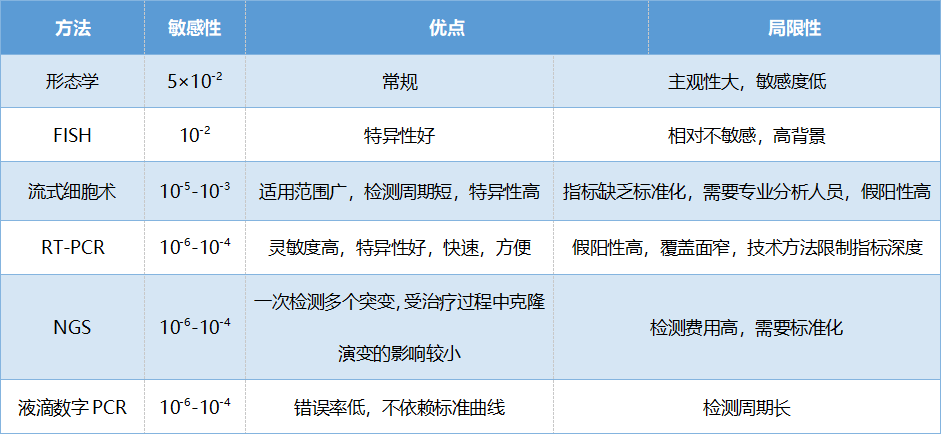
MRD監測技術的發展迅速,臨床應用也趨于常規。目前的MRD監測方法較多,每種方法都有各自優點和局限性(表1)。血液腫瘤相關診療指南推薦,在治療的多個階段多頻次進行MRD監測,包括誘導治療完成后、鞏固治療期間、移植前、全部治療完成后,從而更好地了解白血病的動態變化、更精確地進行風險評估,輔助治療方案選擇。
表1 MRD監測方法的特點
由于每個患者白血病細胞的特異標志不盡相同,加之白血病細胞還帶有很多正常細胞的標志以逃脫機體的免疫監視。因此,如何確定白血病細胞特有的標志最為關鍵。MRD監測的前提是在初診時找到患者白血病細胞特有的標志,例如,采用流式細胞學方法,首先要在初診時分析白血病細胞的十幾種標志,然后找出幾種標志的特定組合作為該白血病細胞的特有標志,后續進行追蹤觀察。
參考文獻
1. van Dongen JJ, van der Velden VH, et al. Minimal residual disease diagnostics in acute lymphoblastic leukemia: need for sensitive, fast, and standardized technologies. Blood, 2015, 125(26): 3996-4009.
2. Ye B, Smerin D, et al. High-throughput sequencing of the immune repertoire in oncology: applications for clinical diagnosis, monitoring, and immunotherapies. Cancer lett., 2018, 416: 42-56.
3. Schnittger S, Kern W, et al. Minimal residual disease levels assessed by NPM1 mutation-specific RQ-PCR provide important prognostic information in AML. Blood, 2009, 114(11): 2220-2231.
4. Roloff GW, Lai C, et al. Technical advances in the measurement of residual disease in acute myeloid leukemia. J Clin Med, 2017, 6(9): 87.